
Рисунок 1. Различные степени рПВР при оценке области базальных ядер
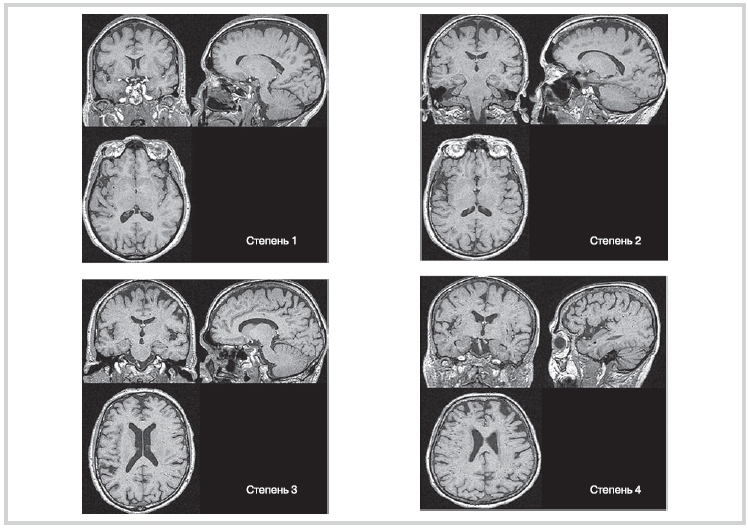
Рисунок 2. Различные степени рПВР при оценке белого вещества головного мозга
Другие параметры МРТ
Объем областей гиперинтенсивного белого вещества (ГБВ) измерили с помощью утвержденного метода автоматизированной проверки изображений и проанализировали в качестве непрерывной переменной. Морфологические параметры (координаты центра масс, Евклидово расстояние до желудочковой системы, размер главных осей) рассчитали для каждой области ГБВ. При расстоянии от желудочковой системы более 10 мм зону ГБВ считали перивентрикулярной, во всех других случаях – глубокой.
Объемы серого, белого вещества и ЦСЖ оценивали с помощью методов воксельной морфометрии, подробно описанных ранее. У каждого участника исследования эти объемы рассчитывали как интеграл интенсивности воксела в соответствующих модулированных изображениях. Общий внутричерепной объем рассчитывали как сумму объемов серого вещества, БВ и ЦСЖ, а фракцию мозгового вещества определили как соотношение объема ткани мозга к общему внутричерепному объему.
Наличие лакунарных инфарктов оценивал по Т1-, Т2- и PD-взвешенным изображениям один и тот же рецензент. Признаком наличия лакунарных инфарктов были очаговые поражения диаметром от 3 до 15 мм, имеющие такие же характеристики сигнала, как и ЦСЖ во всех последовательностях, расположенные в области БГ или БВ, их дифференцировали от расширенных пространств Вирхова-Робина на основании вышеупомянутых критериев.
Ооценка факторов риска
Социально-демографические и клинические данные собирали квалифицированные психологи во время личной беседы с каждым участником исследования по месту его проживания. Считали, что у пациента есть ишемическая болезнь сердца (ИБС), если он указывал на наличие в анамнезе перенесенного инфаркта миокарда, аортокоронарного шунтирования или коронарной ангиопластики. Критериями наличия сахарного диабета были указания на использование противодиабетических препаратов или содержание глюкозы в крови натощак ≥7 ммоль/л. Критериями наличия гиперхолестеринемии были содержание общего холестерина ≥6,2 ммоль/л или использование гиполипидемических препаратов. Систолическое и диастолическое артериальное давление измеряли дважды в положении сидя с интервалом, как минимум, 5 минут. Для анализа использовали среднее значение двух измерений. Критериями наличия артериальной гипертензии (АГ) были повышение артериального давления (систолическое ≥140 мм рт. ст. и диастолическое давление ≥90 мм рт. ст.) или использование гипотензивных препаратов. Выделяли следующие статусы пациентов по отношению к курению: никогда не курил, курение в прошлом и курение в настоящее время. Полиморфизм гена APOE оценивали с помощью процедуры, описанной ранее, и учитывали наличие 4 аллелей APOE. С рецептурных бланков переписывали лекарственные препараты, которые принимали участники в течение 1 месяца до проведения собеседования, и кодировали их, согласно французскому переводу Анатомической терапевтической и химической классификационной системы Всемирной организации здравоохранения (Anatomic Therapeutical Chemical Classification of the World Health Organization).
Статистический анализ
Представлена описательная статистика по исходным потенциальным факторам риска, а также их приблизительное распределение в соответствии с распространенностью рПВР. Для проведения многофакторных перекрестных анализов рассчитали мультиномиальные модели логистической регрессии с рПВР, классифицированными по 4-уровневой системе, в качестве зависимой переменной и рПВР 1 степени в качестве контрольной категории. Каждую последующую категорию (рПВР 2, 3 или 4 степени) сравнивали с контрольной. Отдельные анализы выполнили для моделирования распределения рПВР в области БГ и БВ с учетом возраста, пола и общего внутричерепного объема. Такой же подход использовали для изучения связи между количеством рПВР и другими МР-маркерами. В этом случае в многофакторную модель в качестве переменной также включили наличие АГ. Поскольку выявили только 24 пациента с рПВР 4 степени в области БГ, для оценки риска чрезмерно сильной подгонки также выполнили приблизительные анализы и сравнили с результатами многофакторного анализа. Поскольку получили сходные результаты (данные не приведены), представлены только многофакторные модели. Все значения вероятностей были двусторонне-ограниченными; результаты со значением р<0,05 считали статистически значимыми. Все анализы проводили с использованием SAS версия 9.1 (SAS Institute, Inc, Cary, NC).
Источник:
1. Groeschel S., Chong W.K., Surtees R., Hanefeld F. Virchow-Robin spaces on magnetic resonance images: normative data, their dilatation, and a review of the literature. Neuroradiology. 2006;48:745–754.
2. Ozturk M.H., Aydingoz U. Comparison of MR signal intensities of cerebral perivascular (Virchow-Robin) and subarachnoid spaces. J Comput Assist Tomogr. 2002;26:902–904.
3. Abbott N.J. Evidence for bulk flow of brain interstitial fluid: significance for physiology and pathology. Neurochem Int. 2004;45:545–552.
4. Kwee R.M., Kwee T.C. Virchow-Robin spaces at MR imaging. Radiographics. 2007;27:1071–1086.
5. Fisher C.M. Binswanger’s encephalopathy: a review. J Neurol. 1989;236:65–79.
6. Jungreis C.A., Kanal E., Hirsch W.L., Martinez A.J., Moossy J. Normal perivascular spaces mimicking lacunar infarction: MR imaging. Radiology. 1988;169:101–104.
7. van Swieten J.C., van den Hout J.H., van Ketel B.A., Hijdra A., Wokke J.H., van Gijn J. Periventricular lesions in the white matter on magnetic resonance imaging in the elderly. A morphometric correlation with arteriolosclerosis and dilated perivascular spaces. Brain. 1991;114:761–774.
8. Wardlaw J.M., Doubal F., Armitage P., Chappell F., Carpenter T., Munoz M.S., Farrall A., Sudlow C., Dennis M., Dhillon B. Lacunar stroke is associated with diffuse blood– brain barrier dysfunction. Ann Neurol. 2009;65:194–202.
9. Roher A.E., Kuo Y.M., Esh C., Knebel C., Weiss N., Kalback W., Luehrs D.C., Childress J.L., Beach T.G., Weller R.O., Kokjohn T.A. Cortical and leptomeningeal cerebrovascular amyloid and white matter pathology in Alzheimer’s disease. Mol Med. 2003;9:112–122.
10. Chabriat H., Joutel A., Dichgans M., Tournier-Lasserve E., Bousser M.G. CADASIL. Lancet Neurol. 2009;8:643–653.
11. Alperovitch A. Vascular factors and risk of dementia: design of the Three-City Study and baseline characteristics of the study population. Neuroepidemiology. 2003;22:316–325.
12. Bokura H., Kobayashi S., Yamaguchi S. Distinguishing silent lacunar infarction from enlarged Virchow-Robin spaces: a magnetic resonance imaging and pathological study. J Neurol. 1998;245:116–122.
13. Maillard P., Delcroix N., Crivello F., Dufouil C., Gicquel S., Joliot M., Tzourio-Mazoyer N., Alperovitch A., Tzourio C., Mazoyer B. An automated procedure for the assessment of white matter hyperintensities by multispectral (T1, T2, PD) MRI and an evaluation of its between-centre reproducibility based on two large community databases. Neuroradiology. 2008;50:31–42.
14. Lemaitre H., Crivello F., Grassiot B., Alperovitch A., Tzourio C., Mazoyer B. Age- and sex-related effects on the neuroanatomy of healthy elderly. Neuroimage. 2005;26:900 –911.
15. Dufouil C., Richard F., Fievet N., Dartigues J.F., Ritchie K., Tzourio C., Amouyel P., Alperovitch A. APOE genotype, cholesterol level, lipidlowering treatment, and dementia: the Three-City Study. Neurology. 2005;64:1531–1538.
16. Heier L.A., Bauer C.J., Schwartz L., Zimmerman R.D., Morgello S., Deck M.D. Large Virchow-Robin spaces: MR–clinical correlation. AJNR Am J Neuroradiol. 1989;10:929–936.
17. Vernooij M.W., van der L.A., Ikram M.A., Wielopolski P.A., Niessen W.J., Hofman A., Krestin G.P., Breteler M.M. Prevalence and risk factors of cerebral microbleeds: the Rotterdam Scan Study. Neurology. 2008;70:1208–1214.
18. Doubal F.N., Maclullich A.M., Ferguson K.J., Dennis M.S., Wardlaw J.M. Enlarged perivascular spaces on MRI are a feature of cerebral small vessel disease. Stroke. 2010;41: 450–454.
19. Rouhl R.P., van Oostenbrugge R.J., Knottnerus I.L., Staals J.E., Lodder J. Virchow-Robin spaces relate to cerebral small vessel disease severity. J Neurol. 2008;255:692–696.
20. Weller R.O., Subash M., Preston S.D., Mazanti I., Carare R.O. Perivascular drainage of amyloid-beta peptides from the brain and its failure in cerebral amyloid angiopathy and Alzheimer’s disease. Brain Pathol. 2008;18:253–266.
21. Furuta A., Ishii N., Nishihara Y., Horie A. Medullary arteries in aging and dementia. Stroke. 1991;22:442–446.
22. Fisher C.M. The arterial lesions underlying lacunes. Acta Neuropathol. 1968;12:1–15.
23. Vinters H.V., Gilbert J.J. Cerebral amyloid angiopathy: incidence and complications in the aging brain. II. The distribution of amyloid vascular changes. Stroke. 1983;14:924–928.
24. Potter G.M., Doubal F.N., Jackson C.A., Chappell F.M., Sudlow C.L., Dennis M.S., Wardlaw J.M. Counting cavitating lacunes underestimates the burden of lacunar infarction. Stroke. 2010;41:267–272.

